La carrera de las armas moleculares: la batalla de la humanidad para conseguir los antibióticos de nueva generación
ARTÍCULOS – (18/04/2023)
Imagine un mundo en el que un simple corte le puede llevar al borde de la muerte y las cirugías rutinarias se conviertan en demasiado arriesgadas por la posibilidad de infección. Este escenario distópico puede convertirse en real si no conseguimos ponernos a la cabeza en la carrera por crear armas moleculares contra las bacterias resistentes a los antibióticos. Al tiempo que estos adversarios microscópicos evolucionan, las armas que nos servían para vencerles son cada vez menos efectivas. La carrera ahora se centra en desarrollar antibióticos de nueva generación que puedan vencer a estos invasores.
Los antibióticos son una clase de medicamentos que atacan y destruyen a las bacterias dañinas, ayudando a nuestro organismo a defenderse de las infecciones y mantener una salud óptima. En el contexto de la medicina, estos potentes fármacos han revolucionado la forma en que tratamos las infecciones bacterianas, convirtiendo enfermedades que antes eran mortales en afecciones manejables. Estas se utilizan ampliamente para combatir una serie de infecciones, desde dolencias comunes como la faringitis estreptocócica e infecciones del tracto urinario hasta otras más graves como pueden ser la neumonía bacteriana y la sepsis. En nuestro día a día, los antibióticos se han convertido en el eje de la asistencia sanitaria moderna, haciendo que las intervenciones quirúrgicas y los procedimientos médicos sean más seguros y permitiendo que nos recuperemos más rápidamente de las infecciones bacterianas.
Pero a pesar de sus increíbles beneficios, el uso excesivo y abusivo de los antibióticos ha contribuido al aumento de la resistencia a este tipo de medicamentos. Este fenómeno se produce cuando las bacterias desarrollan mecanismos para eludir los efectos de los antibióticos, haciéndolos ineficaces. A medida que aumenta el número de bacterias que son resistentes a estos medicamentos, se hace cada vez más difícil tratar las infecciones bacterianas, lo que provoca estancias hospitalarias prolongadas y mayores costes sanitarios, llevando en algunos casos, incluso, al fallecimiento.
Las bacterias resistentes a los antibióticos, como el Staphylococcus Aureus resistente a la meticilina (SARM), las enterobacteriáceas resistentes a los carbapenémicos (ERC) y la tuberculosis multirresistente se han convertido en nombres conocidos que infunden temor en pacientes y sanitarios. No nos equivoquemos, esto es una amenaza para la salud mundial. Afecta a personas de todas las edades y orígenes y es, sin duda, uno de los mayores retos de la medicina moderna. Para comprender la gravedad de la situación, volvamos a una época anterior en la que no existían los antibióticos y sigamos las migas de pan hasta dónde estamos ahora.
Antes de la llegada de los antibióticos, la vida era una lucha constante contra enemigos invisibles. Las infecciones bacterianas proliferaban, convirtiendo las heridas leves en sentencias de muerte y las enfermedades tratables en dolencias que debilitaban al cliente o incluso llegaban a ser mortales. La neumonía, la tuberculosis y la faringitis estreptocócica eran solo algunas de las enfermedades que se cobraban innumerables vidas debido a la falta de un tratamiento antibiótico. Incluso una simple astilla podía acabar con tu vida en cuestión de meses.
Médicos y pacientes estaban entonces a merced de estos implacables invasores, recurriendo a menudo a medidas radicales para combatir las infecciones (con mayor o menor éxito). El mundo necesitaba desesperadamente un milagro, un arma poderosa que cambiase las tornas en la guerra contra los patógenos bacterianos.
En 1928, un afortunado giro del destino condujo a un descubrimiento que cambiaría el curso de la historia: Alexander Fleming, un biólogo escocés, tropezó con la penicilina. Fleming había dejado una placa de Petri de la bacteria Staphylococcus descubierta en su laboratorio, solo para descubrir que un moho llamado Penicillium notatum había contaminado la placa. Para su sorpresa, el moho había creado una zona libre de bacterias a su alrededor, lo que indicaba su potencial para combatir las infecciones bacterianas.
Este milagroso avance desencadenó la revolución de los antibióticos, transformando para siempre la medicina y salvando innumerables vidas. Con el paso de los años, se fueron incorporando nuevos antibióticos, cada uno más potente que el anterior, en un arsenal cada vez más potente que el anterior. Sn embargo, las tornas han empezado a cambiar. Nuestro uso excesivo y abusivo de estos fármacos que salvan vidas ha dado lugar a cepas resistentes, minando su eficacia y colocando de nuevo a la humanidad en una situación precaria.
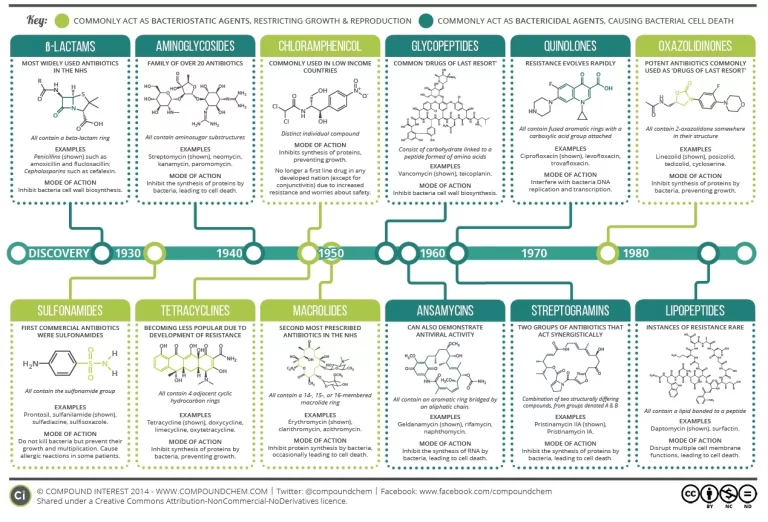
Los antibióticos son de distintos tipos, cada uno con una capacidad única para combatir distintas infecciones. Las penicilinas, por ejemplo, son el tratamiento de referencia para muchas infecciones respiratorias y cutáneas. Funcionan desmantelando las paredes celulares bacterianas, lo que hace que los invasores se rompan por las costuras. Las tetraciclinas adoptan un enfoque diferente, saboteando la síntesis de proteínas bacterianas para mantener a raya infecciones como el acné o la neumonía.
Las historias de los descubrimientos de estas clases de antibióticos son fascinantes. Por ejemplo, las cefalosporinas: la aguda observación del científico italiano Giuseppe Brotzu en 1945 de muestras de aguas residuales que contenían bacterias sensibles a una sustancia producida por el moho Cephalosporium Acremonium condujo al desarrollo del primer antibiótico de cefalosporina, la Cefalotina. Desde entonces, se han utilizado como la “navaja suiza de los antibióticos”, dada su amplia gama de aplicaciones.
Otra historia cautivadora es el descubrimiento del antibiótico Vancomicina, que se ha convertido en un tratamiento crítico de último recurso para muchas infecciones potencialmente mortales. A finales de los años 50, científicos de Eli Lilly descubrieron el antibiótico en una muestra de tierra recogida en las selvas de Borneo. Este potente fármaco interfiere en la síntesis de la pared celular bacteriana, lo que lo convierte en una potente arma contra bacterias resistentes como el SARM.
La búsqueda de antibióticos de nueva generación ha convertido a los investigadores en modernos buscadores de tesoros que rastrean la tierra en busca de joyas médicas ocultas. Algunos se adentran en el mundo de los péptidos antimicrobianos, compuestos presentes en diversos organismos, desde insectos a ranas e incluso saliva humana. Estos péptidos han evolucionado durante millones de años para proteger a sus huéspedes de los patógenos, lo que los convierte en una mina potencial de antibióticos sin explotar.
Otros se aventuran en la biología sintética, con herramientas como los bacteriófagos artificiales o los sistemas CRISPR-Cas para atacar y erradicar bacterias resistentes a los antibióticos con una precisión sin precedentes. Estas tecnologías de vanguardia ofrecen un rayo de esperanza para desarrollar tratamientos específicos que reduzcan la posibilidad de aparición de resistencias.
En los últimos años, los investigadores también han estudiado la posibilidad de reutilizar fármacos existentes para tratar infecciones resistentes a los antibióticos. Por ejemplo, algunos estudios han descubierto que ciertos medicamentos antipsicóticos presentan propiedades antimicrobianas, lo que abre la posibilidad de utilizar estos fármacos en combinación con antibióticos tradicionales para combatir bacterias resistentes.
Pero, ¿cómo hemos llegado aquí?
En un siglo, hemos pasado de la ausencia de antibióticos a un uso excesivo que nos ha llevado a este precipicio. Ganar esta carrera de armamento molecular no consiste solo en crear mejores armas, también en cambiar nuestras tácticas.
Un factor importante que contribuye al aumento de la resistencia a los antibióticos es su uso generalizado en la agricultura. La cría de ganado a menudo implica la administración de antibióticos a los animales para tratar infecciones y promover el crecimiento y prevenir enfermedades en condiciones de hacinamiento y estrés. Este uso rutinario de antibióticos en la cría de animales ha provocado el desarrollo de bacterias resistentes que pueden propagarse a los seres humanos a través del contacto con animales, el consumo de productos alimenticios contaminados y la exposición ambiental.
En el sector sanitario se da otro uso excesivo del medicamento. Los antibióticos se recetan con frecuencia para infecciones víricas, como el resfriado común o la gripe, en las que no tienen ningún efecto. Este consumo innecesario contribuye al desarrollo de la resistencia a los antibióticos, ya que expone a las bacterias a los fármacos sin razón válida.
Además, los pacientes no completan del todo el tratamiento antibiótico porque empiezan a sentirse mejor o se olvidan de tomar la medicación también forman parte del problema. En estos casos, es posible que las bacterias no se erradiquen por completo, lo que permite que los patógenos supervivientes desarrollen resistencia y se propaguen.
Este mal uso de los antibióticos en el ámbito médico y el uso excesivo en la agricultura nos ha llevado a la precaria situación actual, en la que infecciones que antes eran tratables son cada vez más difíciles de combatir.
Debemos promover un uso responsable de los antibióticos, mejorar las herramientas de diagnóstico, explorar terapias alternativas y aplicar políticas de salud pública eficaces. Fundamentalmente, tenemos que cambiar la forma en que nuestra sociedad utiliza los antibióticos; de lo contrario, nos encontraremos en un círculo vicioso, abusando constantemente de nuestras salvaguardias esenciales y poniéndonos de nuevo en peligro. Si abordamos este problema desde todos los ángulos, podremos mantener a raya la resistencia a los antibióticos y salvaguardar el futuro de la medicina moderna.
La inversión en investigación y desarrollo también es esencial para ir por delante en esta carrera armamentística molecular. Con el apoyo de fondos públicos y privados, los científicos pueden seguir explorando estrategias innovadoras y desarrollando nuevos antibióticos para combatir la resistencia.
En esta batalla de alto riesgo contra enemigos microscópicos, cada descubrimiento, innovación y cambio político nos acerca un paso más a la victoria. Juntos podemos superar la resistencia a los antibióticos para que salvar vidas siga a nuestro alcance para las generaciones venideras. El resultado de esta carrera armamentística molecular está en nuestras manos y es una lucha que debemos ganar por el bien del futuro de la humanidad.